
(Translation from English by Adolfo Gómez-Urda Montijano, University of Granada, Spain)
Volver al Índice de Aerogeles
La discusión posterior se basa en los siguientes términos:
Por lo general, la formación de aerogeles comprende dos pasos principales: la formación de un gel húmedo y el secado del gel húmedo para formar un aerogel. En un principio, los geles húmedos se preparaban mediante la condensación acuosa del silicato de sodio o de un material similar. A pesar del buen funcionamiento de este proceso, la reacción formaba sales dentro del gel que sólo se podían extraer lavándo el gel una y otra vez (procedimiento largo y laborioso). Gracias al rápido desarrollo de la química sol-gel durante las últimas décadas, la gran mayoría de los aerogeles de sílice que se preparan en la actualidad utiliza precursores de alcoxilo de silicona. Los más utilizados son el tetrametil ortosilicato (TMOS, Si(OCH3)4) y el ortosilicato tetraetilo (TEOS, Si(OCH2CH3)4). Sin embargo, se pueden utilizar muchos otros alcoxilos que contengan varios grupos funcionales orgánicos para que el gel adquiera propiedades diferentes. La química sol-gel basada en alcoxilos evita la formación de los poco deseados productos derivados de la sal, además de posibilitar un control mucho mayor sobre el producto final. La ecuación química equilibrada para la formación de un gel de sílice a partir de TEOS es:
Si(OCH2CH3)4 (líquido) = SiO2 (sólido) + 4HOCH2CH3 (líquido)
Esta reacción normalmente se lleva a cabo en etanol; la densidad final del aerogel depende de la concentración de los monómeros de alcoxilo de silicona que hay en la solución. Cabe destacar que la estoiquiometría de la reacción precisa dos moles de agua por cada mol de TEOS. En la práctica, esta cantidad de agua tiene como consecuencia una reacción incompleta y unos aerogeles débiles y empañados. La mayoría de las fórmulas para preparar aerogeles utiliza por tanto un mayor porcentaje de agua del que aconseja la ecuación equilibrada (entre 4 y 30 equivalentes).
La cinética de la reacción anterior es poco práctica por su lentitud a temperatura ambiente, por lo que a menudo se necesitan varios días para llevarla a cabo totalmente. Para acortar el proceso se añaden catalizadores ácidos o básicos a la fórmula. Las propiedades microestructurales, físicas y ópticas del producto de aerogel final dependerán de la cantidad y el tipo de catalizador que se emplee.
Los catalizadores ácidos pueden consistir en un ácido prótido cualquiera, como el HCl. Los catalizadores básicos por lo general utilizan amoníaco o amoníaco amortiguado con fluoruro amónico. Los aerogeles preparados con catalizadores ácidos normalmente encogen más durante el secado supercrítico y pueden ser menos transparentes que los aerogeles preparados con un catalizador básico. La descripción precisa de los efectos microestructurales de varios catalizadores es bastante compleja, ya que la subestructura de las partículas primarias de los aerogeles puede ser difícil de distinguir con un microscopio electrónico. Todos contienen unas partículas pequeñas (2-5nm de diámetro), normalmente esféricas o con forma de huevo. Por el contrario, en el caso de los catalizadores ácidos, estas partículas pueden resultar «menos sólidas» (con la apariencia de una bola de cuerda) que las obtenidas en los geles preparados con catalizadores básicos.
A medida que progresan las reacciones de condensación, el sol se convertirá en un gel rígido. Es en este punto cuando normalmente se extrae el gel del molde, aunque hay que mantener cubierto el gel con alcohol para evitar que evapore el líquido contenido dentro de los poros del gel. La evaporación puede dañar seriamente el gel y disminuir la calidad del aerogel resultante.
Los geles normales preparados a partir de TEOS con catalizadores ácidos o con catalizadores básicos suelen encuadrarse dentro de los geles «de un paso» (para la reacción sólo se necesita «un recipiente»). Un método desarrollado recientemente emplea TEOS pre-polimerizado como fuente de sílice. El TEOS pre-polimerizado se prepara calentando una solución de etanol de TEOS con una cantidad sub-estoiquiométrica de agua y un catalizador ácido. El solvente se extrae mediante destilación, quedando un fluido viscoso que contiene óxido-alcoxilo de silicona de un peso molecular superior. Este material se redisuelve en etanol y reacciona con el agua restante bajo condiciones básicas hasta que se produce la gelatinación. Los geles que se preparan siguiendo este método se denominan geles catalizados ácidos/ básicos «de dos pasos». El TEOS pre-polimerizado se encuentra disponible en los EEUU y es comercializado por Silbond Corp. (Silbond H-5).
Estas condiciones de procesamiento ligeramente distintas provocan unos pequeños pero importantes cambios en el producto final de aerogel. Normalmente, los aerogeles preparados mediante un catalizador básico de un paso son mecánicamente más fuertes, aunque también más quebradizos, que los aerogeles de dos pasos. Sin embargo, los aerogeles de dos pasos tienen una distribución del tamaño de los poros más pequeña y estrecha, además de ser normalmente más transparentes ópticamente que los aerogeles de un solo paso.
Las reacciones de hidrólisis y de condensación del reactivo alcoxilo de silicona a menudo se consideran completas cuando el sol alcanza el punto de gel, aunque no suele ser este el caso. El punto de gel no es más que el momento en que las especies de sílice que se encuentran bajo el proceso de polimerización abarcan el volumen del contenedor donde está el sol. En ese momento la columna de sílice del gel contiene una importante cantidad de grupos alcoxilos sin reaccionar. De hecho, aún puede darse hidrólisis y condensación hasta que se complete la gelatinación. Uno de los errores más comunes en la preparación de aerogeles de sílice se comete al no tener en cuenta ese aspecto. La solución es fácil, hay que tener paciencia. La red de sílice será más fuerte si se le da el tiempo suficiente. Este proceso puede tener un mejor resultado controlando el pH y el contenido de agua de la solución que cubre el aerogel. Uno de los procedimientos que se suelen utilizar para la maduración de los geles catalizados básicos consiste en remojar el gel en una mezcla de alcohol y agua proporcional al sol original bajo un pH de 8-9 (amoníaco). Es recomendable dejar reposar los geles en esta solución hasta un máximo de 48 horas.
Este paso, así como los posteriores pasos de procesamiento, es controlado mediante difusión. O sea que la introducción o extracción de material dentro o fuera del gel no se ve afectada por convección o mezcla (debido a la solidez de la red de sílice). Sin embargo, la difusión sí se ve afectada por el grosor del gel. En breve, el tiempo necesario para cada paso de procesamiento aumenta de forma radical a medida que aumenta el grosor del gel. Este hecho limita la producción práctica de los aerogeles a piezas de 1 a 2 centímetros de grosor.
Una vez haya madurado el gel y antes de proceder al secado, se debe extraer todo el agua que queda dentro de los poros. Para ello, se debe remojar el gel varias veces en alcohol puro hasta que no quede nada de agua. Una vez más, el tiempo que se necesita para este proceso depende del grosor del gel. Si se deja agua dentro del gel, ésta no podrá ser extraída mediante el secado supercrítico, por lo que el resultado será un aerogel opaco, blanco y muy denso.
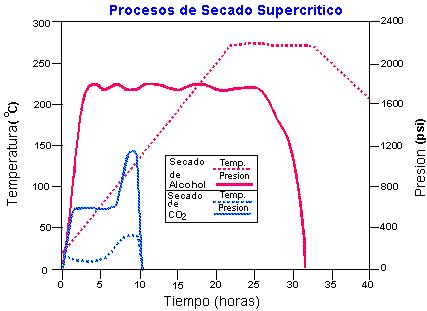
El último proceso y el más importante a la hora de preparar aerogeles de sílice es el secado supercrítico. Durante este proceso se extrae el líquido remanente dentro del gel, dejando sólo la red de sílice entrelazada. El proceso se puede llevar a cabo mediante la evaporación de etanol por encima de su punto crítico (altas temperaturas, o sea muy peligroso) o mediante un intercambio del solvente con CO2 seguido de una evaporación supercrítica (bajas temperaturas, o sea menos peligroso). Este proceso se debe llevar a cabo en una autoclave especialmente diseñada para este fin (en el caso del secado de CO2 se pueden utilizar las autoclaves de poco tamaño que emplean los usuarios de microscopios electrónicos para preparar muestras biológicas). El proceso consiste en los pasos siguientes: los alcogeles se colocan en la autoclave (previamente rellenada con etanol). Después se presuriza el sistema a una presión de al menos 750-850psi con CO2 y se enfría hasta alcanzar los 5-10ºC. Se introduce CO2 líquido dentro del recipiente hasta que se haya extraído todo el etanol de dicho recipiente y del interior de los geles. Cuando ya no quede etanol en los geles, se calienta el recipiente hasta una temperatura superior a la temperatura crítica del CO2 (31ºC). A medida que se calienta el recipiente, aumenta la presión del sistema. Se suelta el CO2 con cuidado para mantener una presión ligeramente superior a la presión crítica del CO2 (1050psi). El sistema debe mantenerse bajo estas condiciones durante un corto periodo de tiempo. A continuación se suelta de forma lenta y controlada el CO2 a temperatura ambiente. Como en los pasos anteriores, el tiempo que se necesita para llevar a cabo este proceso depende del grosor de los geles. El proceso puede durar entre 12 horas y 6 días. Tras este proceso se puede abrir el recipiente y admirar así la belleza intrínseca de los aerogeles.
La gráfica siguiente muestra las condiciones del proceso de sustitución/ secado con dióxido de carbono y las del proceso de secado con alcohol.
Aerogel de sílice catalizado básico de un paso
Para preparar un aerogel con una densidad aproximada de 0,08g/cm3, el tiempo de gel debería estar entre los 60 y los 120 minutos, dependiendo de la temperatura.
Aerogel de sílice catalizado básico de dos pasos
Para preparar un aerogel con una densidad aproximada de 0,08g/cm3, el tiempo de gel debería estar entre los 30 y los 90 minutos, dependiendo de la temperatura.
Back to the Aerogels Table of Contents | Preguntas sobre Aerogel/Science Questions? | Webmaster